พันธะเคมี เป็นแรงดึงดูดที่เกิดขึ้นจากความไม่เสถียรของอะตอมหรือธาตุต่าง ๆ ในธรรมชาติ ซึ่งกว่า 90 ธาตุที่พบในธรรมชาติ มีเพียงธาตุในหมู่ VIIIA หรือก๊าซเฉื่อย (Inert Gas) เท่านั้นที่สามารถคงอยู่ในรูปของอะตอมอิสระ จากการมีอิเล็กตรอนวงนอกสุดเต็มตามจำนวนในแต่ละระดับชั้นของพลังงาน หรือ มีเวเลนซ์อิเล็กตรอน (Valence Electron) ครบ 8 ตัว ทำให้โครงสร้างของอะตอมมีความเสถียรในตัวเองสูง
3.1 สัญลักษณ์เเบบจุดของลิวอีสเเละกำออกเตต
พัฒนาการของตารางธาตุ ตลอดจนแนวคิดของการจัดอิเล็กตรอน ช่วยให้นักเคมีสามารถอธิบายการเกิดโมเลกุลหรือสารประกอบได้อย่างมีเหตุผล กิลเบิร์ต ลิวอิส (Gilbert Newton Lewis) เสนอว่า อะตอมรวมตัวกันเพื่อทำให้เกิดการจัดอิเล็กตรอนที่มีเสถียรภาพเพิ่มขึ้น โดยเสถียรภาพมีค่ามากที่สุดเมื่ออะตอมมีจำนวนอิเล็กตรอนเท่ากับจำนวนอิเล็กตรอนในธาตุเฉื่อย เมื่ออะตอมรวมกันเกิดเป็นพันธะเคมี อิเล็กตรอนระดับนอกหรือที่เรียกว่า เวเลนซ์อิเล็กตรอนเท่านั้นที่เกี่ยวข้องกับการเกิดพันธะเคมี นักเคมีใช้สัญลักษณ์แบบจุดของลิวอิส ในการนับจำนวนเวเลนซ์อิเล็กตรอนระหว่างปฏิกิริยา และเพื่อให้แน่ใจว่าจำนวนอิเล็กตรอนมีค่าคงที่ สัญลักษณ์แบบจุดของลิวอิส ประกอบด้วยสัญลักษณ์ ธาตุ และจุด 1 จุด แทน 1 เวเลนซ์อิเล็กตรอนของอะตอมธาตุนั้น เช่น โลหะในหมู่ I Aซึ่งมีเวเลนซ์ อิเล็กตรอน 1 ตัว จะมีสัญลักษณ์ ดังนี้
ตารางที่ 2 แสดงสัญลักษณ์แบบจุดของลิวอิสของธาตุ
กฎออกเตต ( Octet rule)
ลิวอิส ได้เสนอกฎออกเตต ซึ่งกฎนี้กล่าวว่า อะตอมต่าง ๆ นอกจากไฮโดรเจนมีแนวโน้มจะสร้างพันธะ เพื่อให้มีอิเล็กตรอนระดับนอกครบแปด อะตอมจะสร้างพันธะโคเวเลนต์ เมื่อมีอิเล็กตรอนระดับนอกไม่ครบ 8 อิเล็กตรอน (เรียกว่า ไม่ครบออกเตต) การใช้อิเล็กตรอนร่วมกันในพันธะโคเวเลนต์ จะทำให้อะตอมมีอิเล็กตรอนครบออกเตตได้ ยกเว้นไฮโดรเจนจะสร้างพันธะเพื่อให้มีการจัดอิเล็กตรอนระดับนอกเหมือนธาตุฮีเลียม คือ มี 2 อิเล็กตรอน เช่น
กฎออกเตตใช้ได้ดีกับธาตุในคาบที่ 2 ของตารางธาตุ ซึ่งธาตุเหล่านั้นมีอิเล็กตรอนระดับนอกอยู่ใน 2s และ 2p ออร์บิทัล ซึ่งรับอิเล็กตรอนได้ไม่เกิน 8 อิเล็กตรอน ข้อยกเว้นของกฎออกเตต
1) กรณีโมเลกุลที่อะตอมกลางมีอิเล็กตรอนเกินแปด ธาตุบางธาตุในคาบที่ 3 เช่น ฟอสฟอรัส (P) หรือ กำมะถัน (S) สามารถมีอิเล็กตรอนระดับนอกได้เกิน 8 ตัว (เพราะจำนวนอิเล็กตรอนในระดับพลังงาน n = 3 มีอิเล็กตรอนได้สูดสุด 18 ตัว) จึงทำให้ฟอสฟอรัสและกำมะถัน สามารถสร้างพันธะโคเวเลนต์ โดยใช้อิเล็กตรอนมากกว่า 8 ตัว ได้ เช่น ฟอสฟอรัสเพนตะคลอไรด์ (PCl 5 )
2) กรณีของโมเลกุลที่อะตอมกลางมีอิเล็กตรอนไม่ครบแปดในสารประกอบบางชนิด อะตอมกลางของโมเลกุลที่เสถียรมีอิเล็กตรอนไม่ครบ 8 อิเล็กตรอน เช่น โบรอนไตรฟลูออไรด์ (BF 3 )
VIDEO
3.2 พันธะไอออนิก
เป็นพันธะที่เกิดจากการที่อะตอมหนึ่งเป็นฝ่ายให้อิเล็กตรอนระดับนอก และอีกอะตอมหนึ่งเป็นฝ่ายรับอิเล็กตรอนเข้ามาสู่ระดับนอก แล้วทำให้อะตอมทั้งสองฝ่ายอยู่ในสภาพเสถียร (ครบ 8 ตามกฎออกเตต) เช่น ธาตุในหมู่ 1A ซึ่งมีเวเลนซ์อิเล็กตรอนเท่ากับ 1 ถ้าเอาอิเล็กตรอนตัวนี้ออกไปเสีย อิเล็กตรอนในระดับถัดเข้าไปจะมีจำนวนเท่ากับ 8 ซึ่งเป็นโครงสร้างที่เสถียรเหมือนแก๊สเฉื่อย เช่น Na มีโครงสร้างอิเล็กตรอนเป็น 1s2 2s22p6 3s1 ถ้าเอาอิเล็กตรอน 3s1 ออกไป จะเกิดเป็น Na+ จะมีโครงสร้างอิเล็กตรอนเป็น 1s2 2s2 2p6 ซึ่งมีเวเลนซ์อิเล็กตรอนเท่ากับ 8 ซึ่งเป็นโครงสร้างที่เสถียรเหมือนแก๊สเฉื่อย คือ Ne ซึ่งมีโครงสร้างอิเล็กตรอนคือ 1s2 2s22p6 ส่วนธาตุในหมู่ 7A มีเวเลนซ์อิเล็กตรอนเท่ากับ 7 ต้องการอีก 1 ตัว จะครบ 8 เช่น Cl มีโครงสร้างอิเล็กตรอนเป็น 1s2 2s2 2p6 3s2 3p5 ถ้ารับอิเล็กตรอนเข้ามาหนึ่งตัวจะกลายเป็น Cl – โครงสร้างอิเล็กตรอนจะเปลี่ยนเป็น 1s2 2s2 2p6 3s2 3p6 ซึ่งเหมือนโครงสร้างอิเล็กตรอนของ Ar ซึ่งเป็นธาตุเฉื่อย
อะตอมที่มีอิเล็กตรอนระดับนอกจำนวนน้อย มีพลังงานการแตกตัวเป็นไอออนต่ำและมีสัมพรรคภาพอิเล็กตรอนต่ำ มีแนวโน้มที่จะเสียอิเล็กตรอนระดับนอกไปแล้วกลายเป็นไอออนบวก ส่วนธาตุที่มีอิเล็กตรอนระดับนอกมากมีพลังงานการแตกตัวเป็นไอออนสูง มีสัมพรรคภาพอิเล็กตรอนสูง มีแนวโน้มจะรับอิเล็กตรอนได้ง่ายและกลายเป็นไอออนลบ เมื่ออะตอมเหล่านี้ถ่ายโอนอิเล็กตรอนให้แก่กันแล้วเกิดเป็นไอออนบวกและไอออนลบ ซึ่งมีประจุไฟฟ้าต่างกันจึงเกิดแรงดึงดูดกันทางไฟฟ้ายึดเหนี่ยวให้ไอออนทั้งสองอยู่ด้วยกัน พันธะระหว่างไอออนบวกและไอออนลบนี้เรียกว่า พันธะไอออนิก หรือพันธะอิเล็กโทรเวเลนซ์ และเรียกสารประกอบที่เกิดขึ้นว่า สารประกอบไอออนิก
VIDEO
3.2.2 สูตรเคมีและชื่อของสารประกอบไออนิก
เนื่องจากสารประกอบไอออนิกมีลักษณะการสร้างพันธะต่อเนื่องกันเป็นผลึก ไม่ได้อยู่ในลักษณะของโมเลกุลเหมือนในสารประกอบโคเวเลนต์ ดังนั้นสารประกอบไอออนิกจึงไม่มีสูตรโมเลกุลที่แท้จริง แต่จะมีการเขียนสูตรเพื่อแสดงอัตราส่วนอย่างต่ำของจำนวนธาตุต่าง ๆ ที่เป็นองค์ประกอบ เช่น โซเดียมคลอไรด์ เกิดจากอะตอมของธาตุโซเดียม (Na) อย่างน้อยที่สุด 1 อะตอม และอะตอมของธาตุคลอรีน (Cl) อย่างน้อยที่สุด 1 อะตอม จึงสามารถเขียนสูตรได้เป็น NaCl โดยการเขียนสูตรของสารประกอบไอออนิกจะเขียนนำด้วยธาตุที่เกิดเป็นไอออนบวกก่อน จากนั้นจึงเขียนตามด้วยธาตุที่เกิดเป็นไอออนลบตามลำดับ
วิธีการอ่านชื่อสารประกอบไอออนิกให้อ่านตามลำดับของธาตุที่เขียนในสูตร คือ เริ่มจากธาตุแรกซึ่งเกิดเป็นไอออนบวก (ธาตุโลหะ) แล้วตามด้วยธาตุหลังซึ่งเป็นไอออนลบ (ธาตุอโลหะ) ดังนี้
1) เริ่มจากอ่านชื่อไอออนบวก (ธาตุโลหะ) ก่อน
2) อ่านชื่อธาตุไอออนลบ (ธาตุอโลหะ) โดยเปลี่ยนเสียงสุดท้ายเป็น -ไอด์ (-ide) ดังตัวอย่างเช่น
NaCl อ่านว่า โซเดียมคลอไรด์
MgO อ่านว่า แมกนีเซียมออกไซด์
Al2O3 อ่านว่า อะลูมิเนียมออกไซด์
3) หากไอออนลบมีลักษณะเป็นกลุ่มธาตุ จะมีชื่อเรียกเฉพาะที่แตกต่างกัน เช่น No3- เรียกว่า ไนเดรต, CO32-เรียกว่า คาร์บอเนต, SO42- เรียกว่า ซัลเฟต OH- เรียกว่า ไฮดรอกไซด์ เป็นต้น ดังตัวอย่างเช่น
CaCO3 อ่านว่า แคลเซียมคาร์บอเนต
Na2SO4 อ่านว่า โซเดียมซัลเฟต
อัตราส่วนระหว่างไอออนบวกกับไอออนลบที่จะรวมตัวกันเป็นสารไอออนิกนั้น จะใช้อัตราส่วนที่ทำให้ประจุบวกกับประจุลบหักล้างกันหมดพอดี โดยเราสามรถใช้ค่าของประจุบวกไปเขียนไว้ทางด้านล่างขวาของอนุภาคที่เป็นไอออนลบ และใช้ค่าประจุลบไปเขียนไว้ทางด้านล่างขวาของอนุภาคที่เป็นไอออนบวก ดังรูป
สารประกอบไอออนิกประกอบด้วยไอออนบวกและไอออนลบยึดเหนี่ยวกันด้วยแรงดึงดูดระหว่างประจุไฟฟ้าในการเขียนสูตรสารประกอบไอออนิกจึงต้องทราบว่าแต่ละธาตที่ทำปฏิกิริยากัน นั้นจะเกิดเป็นไอออนชนิดใด และมีจำนวนประจุเท่าใด ซึ่งพิจารณาได้จากการจัดเรียงอิเล็กตรอนของธาตุ
3.2.3 พลังงานกับการเกิดสารประกอบไอออนิก
1) โลหะโซเดียมที่อยู่ในสถานะของแข็งระเหิดกลายเป็นไอ (กลายเป็นอะตอมในสถานะก๊าซ) ขั้นนี้ต้องใช้พลังงาน หรือดูดพลังงานเท่ากับ 109 kJ/mol เรียกพลังงานที่ใช้ในขั้นนี้ว่าพลังงานการระเหิด (Heat of siblimation) สัญลักษณ์ "
Na(s)+ 109 kJ---------------->Na(g).........(1)
2) โมเลกุลของคลอรีน (Cl2(g)) ซึ่งอยู่ในสถานะก๊าซแตกตัวออกเป็นอะตอมในสถานะก๊าซ (Cl(g))
Cl
แต่ในการเกิด NaCl(s) 1 mol ต้องใช้ Cl(g) เพียง 1 mol ดังนั้น
ขั้นนี้ต้องใช้พลังงานหรือดูดพลังงานเท่ากับ 121 kJ เรียกพลังงานที่ใช้ในขั้นนี้ว่า พลังงานสลายพันธะ หรือพลังงานการแตกตัว (Bond Dissociation energy) สัญลักษณ์ "
3) อะตอมของโซเดียมในสถานะก๊าซ เสีย 1 เวเลนซ์อิเลคตรอน กลายเป็นโซเดียมไอออนในสถานะก๊าซ ขั้นนี้ต้องใช้พลังงานหรือดูดพลังงาน 494 kJ/mol เรียกพลังงานที่ใข้ในขั้นนี้ว่า พลังงานไอออไนเซชั่น(Ionization Energy) สัญลักษณ์ "IE" หรือ "I"
Na(g)+494 kJ----------------->Na
4) คลอรีนอะตอมในสถานะก๊าซรับอิเลคตรอนกลายเป็นคลอไรด์ไอออนในสถานะก๊าซ(Cl-(g)) ขั้นนี้คายพลังงานออกมา 347 kJ/mol พลังงานที่คายออกมาในขั้นนี้เรียกว่า อิเลคตรอนอัฟฟินิตีหรือสัมพรรคภาพอิเลคตรอน (Electron Affinity) สัญลักษณ์ E หรือ EA
Cl(g)+e- -----------------> Cl-(g)+347 kJ...........(4)
5) โซเดียมไอออนในสถานะก๊าซ และคลอไรด์ไอออนในสถานะก๊าซรวมตัวกันด้วยพันธะไอออนิกได้ผลึกโซเดียมครอไรด์ (NaCl(s)) ขั้นนี้คายพลังงานออกมา 787 kJ/mol พลังงานที่คายออกมาในขั้นนี้เรียกว่าพลังงานแลคทิซ หรือพลังงานโครงร่างผลึก (Lattic Energy) สัญลักษณ์ U หรือ Ec
Na+(g) + Cl-(g) ---------------------->NaCl(s)+787 kJ.........(5)
เมื่อเอาสมการ (1)+(2)+(3)+(4)+(5) จะได้สมการรวมหรือปฏิกิริยารวมดังนี้
Na(s)+ Cl (g)-----------------------> NaCl(s)+410 kJ..........(6)
VIDEO
VIDEO
3.2.4 สมบัติของสารประกอบไอออนิก
1) มีขั้ว เพราะสารประกอบไอออนิกไม่ได้เกิดขึ้นเป็นโมเลกุลเดี่ยว แต่จะเป็นของแข็งซึ่งประกอบด้วยไอออนจำนวนมาก ซึ่งยึดเหนี่ยวกันด้วยแรงยึดเหนี่ยวทางไฟฟ้า
2) ไม่นำไฟฟ้าเมื่ออยู่ในสภาพของแข็ง แต่จะนำไฟฟ้าได้เมื่อใส่สารประกอบไอออนิกลงในน้ำ ไอออนจะแยกออกจากกัน ทำให้สารละลายนำไฟฟ้าในทำนองเดียวกันสารประกอบที่หลอมเหลวจะนำไฟฟ้าได้ด้วยเนื่องจากเมื่อหลอมเหลวไอออนจะเป็นอิสระจากกัน เกิดการไหลเวียนอิเล็กตรอนทำให้อิเล็กตรอนเคลื่อนที่จึงเกิดการนำไฟฟ้า
3) มีจุหลอมเหลวและจุดเดือดสูง ความร้อนในการทำลายแรงดึงดูดระหว่างไอออนให้กลายเป็นของเหลวต้องใช้พลังงานสูง
ตารางแสดงจุดหลอมเหลว และจุดเดือดของสารประกอบไอออนิกบางชนิด
สารประกอบไอออนิก สูตรโมเลกุล จุดหลอมเหลว ( ๐ C) จุดเดือด ( ๐ C)
โซเดียมไฮดรอกไซด์ NaOH 318 1390 โพแทสเซียมไนเดรต KNO3 แคลเซียมคลอไรด์ CaCl2 มากกว่า 1600 โซเดียมคลอไรด์ NaCl 801 1465 อะลูมิเนียมออกไซด์ Al2 3 แมกนีเซียมออกไซด์ MgO 2800 3600
5) สมบัติไม่แสดงทิศทางของพันธะไอออนิก สารประกอบไอออนิกเกิดจากไอออนที่มีประจุตรงกันข้ามรอบ ๆ ไอออนแต่ละไอออนจะมีสนามไฟฟ้าซึ่งไม่มีทิศทาง จึงทำให้เกิดสมบัติไม่แสดงทิศทางของพันธะไอออนิก
6) เป็นผลึกแข็ง แต่เปราะและแตกง่าย
VIDEO
3.2.5 สมการไอออนิกและสมการไออนิกสุทธิ
เมื่อผสมสารละลายของสารประกอบไอออนิกบางชนิดเข้าด้วยกัน จะได้สารละลายที่มีไอออนของสารทั้งสองปนกันอยู่ ปรากฏเป็นสารละลายใส เช่น ผสม NaCl (aq) กับ KNO3 (aq) เขียนสมการเคมีที่เกิดขึ้นได้ดังนี้
= NaCl (aq) + KNO3 (aq) ---------> NaNO3 (aq) + KCl (aq) หรือ
Na+ (aq) + Cl-(aq) + K+(aq) +NO3-(aq) ------------> Na+ (aq) + NO3-(aq) + K+(aq) + Cl-(aq)
เมื่อผสมกัน จะมีไอออนอยู่ในสารละลายทั้ง 4 ชนิด แสดงว่า ไม่เกิดผลิตภัณฑ์ที่เป็นของแข็ง จึงอยู่ใน สภาพไอออน (มีน้ำล้อมรอบ) แต่เมื่อผสมสารละลายของสารประกอบไอออนิกบางชนิดเข้าด้วยกัน จะได้ผลิตภัณฑ์เป็นตะกอน
เกิดขึ้น เช่น ผสม NaCl (aq) กับ AgNO3 (aq) เขียนสมการเคมีที่เกิดขึ้นได้ดังนี้
= NaCl (aq) + AgNO3 (aq) -----------------> NaNO3 (aq) + AgCl (s) หรือ
Na+ (aq) + Cl-(aq) + Ag+(aq) +NO3-(aq) ---------------> Na+ (aq) + NO3-(aq) + AgCl(s)
เมื่อผสมกันจะเกิดตะกอนของ AgCl(s) เขียนสมการแสดงการเกิดตะกอน AgCl ดังนี้
= Ag+(aq) + Cl-(aq) ---------------> AgCl(s) เรียกสมการนี้ว่า สมการไอออนิก
สมการไอออนิก (Ionic equation ) คือ สมการเคมีที่เขียนเฉพาะไอออนหรือโมเลกุลของสารที่มีส่วน ในการเกิดปฏิกิริยา ส่วนไอออนหรือโมลกุลของสารใดไม่มีส่วนในการเกิดปฏิกิริยาไม่ต้องเขียน สมการไอออนิก จะต้องเป็น สมการที่มีสารใดสารหนึ่งเป็นไอออนร่วมอยู่ด้วยในปฏิกิริยานั้น เช่น
Zn (s) + 2H+ (aq) ---------------> Zn2+ (aq) + H2 (g)
H+ (aq) + OH- (aq) --------------------> H2O (l)
หลักการเขียนสมการไอออนิก
VIDEO
3.3 พันธะโคเวเลนต์ 3.3.1 การเกิดพันธะโคเวเลนต์ พันธะโคเวเลนต์ คือ พันธะเคมีที่เกิดขึ้นระหว่างอะตอมของธาตุอโลหะกับธาตุโลหะที่เข้ามาสร้างแรงยึดเหนี่ยวต่อกัน เนื่องจากธาตุอโลหะจะมีสมบัติเป็นตัวรับอิเล็กตรอนที่ดีและยากต่อการสูญเสียอิเล็กตรอน ดังนั้นอิเล็กตรอนของธาตุทั้งสองจึงต่างส่งแรงดึงดูดเพื่อที่จะดึงดูดอิเล็กตรอนของอีกฝ่ายให้เข้าหาตนเอง ทำให้แรงดึงดูดจากนิวเคลียสของอะตอมทั้งสองหักล้างกัน ดังนั้นอิเล็กตรอนจึงไม่มีการหลุดไปอยู่ในอะตอมใดอะตอมหนึ่งโดยเฉพาะ แต่จะมีลักษณะเหมือนเป็นอิเล็กตรอนที่อยู่กึ่งกลางระหว่างอะตอมทั้งสอง เรียกอิเล็กตรอนที่อยู่กึ่งกลางอะตอมทั้งสอง เรียกอิเล็กตรอนที่ถูกอะตอมใช้ร่วมกันในการสร้างพันธะเคมีว่า อิเล็กตรอนคู่ร่วมพันธะ( Bonding pair electron)
พันธะโคเวเลนต์ของอะตอมเกิดขึ้นจากการใช้อิเล็กตรอนร่วมกันของอะตอม โดยอาจเกิดจากการใช้อิเล็กตรอนร่วมกันเพียงคู่เดียว สองคู่ หรือสามคู่ก็ได้ขึ้นอยู่กับอะตอมคู่ที่เข้ามร่วมสร้างพันธะกันว่ายังขาดเวเลนซ์อิเล็กตรอนอยู่อีกเท่าใดจึงจะครบ 8 ตามกฎออกเตต ดังนั้นพันธะโคเวเลนต์จึงสามารถแบ่งออกได้เป็น 3 ชนิด ตามจำนวนอิเล็กตรอนที่มีการใช้ร่วมกัน ดังนี้ 1) พันธะเดี่ยว (single bond) คือ พันธะโคเวเลนต์ที่เกิดจากอะตอมคู่ที่เข้ามาร่วมสร้างพันธะต่อกันมีการใช้ร่วมสร้างพันธะต่อกันมีการใช้อิเล็กตรอนร่วมกัน 1 คู่
2) พันธะคู่ (double bond) คือ พันธะโคเวเลนต์ที่เกิดจากอะตอมคู่ที่เข้ามาร่วมสร้างพันธะต่อกันมีการใช้อิเล็กตรอนร่วมกัน 2 คู่
3) พันธะสาม (triple bond) คือ พันธะโคเวเลนต์ที่เกิดจากอะตอมคู่ที่เข้ามาร่วมสร้างพันธะต่อกัน มีการใช้อิเล็กตรอนร่วมกัน 3 คู่
3.3.2 สูตรโมเลกุลและชื่อของสารโคเวเลนต์
การเรียกชื่อสารประกอบโคเวเลนต์ (Names of Covalent Compounds)
1) อ่านชื่อธาตุที่อยู่ด้านหน้าก่อนตามด้วยธาตุที่อยู่ด้านหลัง โดยเปลี่ยนเสียงพยางค์ท้ายเป็น ไ-ด์ (ide )
2) อ่านระบุจำนวนอะตอมของธาตุด้วยเลขจำนวนในภาษากรีก ได้แก่
1 = mono- 2 = di- 3 = tri-
4 = tetra- 5 = penta- 6 = hexa
7 = octa- 8 = nona- 9 = deca
3) ถ้าธาตุแรกมีอะตอมเดียว ไม่ต้องอ่านระบุจำนวนอะตอมของธาตุนั้น แต่ถ้าธาตุหลังมีเพียงหนึ่งอะตอมก็ต้องระบุจำนวนอะตอมด้วยเสมอ
ตัวอย่างการอ่านชื่อ
CO2 อ่านว่า คาร์บอนไดออกไซด์
CO อ่านว่า คาร์บอนมอนออกไซด์
BF3 อ่านว่า โบรอนไตรฟลูออไรด์
N2O อ่านว่า ไดไนโตรเจนมอนอกไซด์
N2O5 อ่านว่า ไดไนโตรเจนเพนตอกไซด์
P4O10 อ่านว่า เตตระฟอสฟอรัสเดคะออกไซด์
OF2 อ่านว่า ออกซิเจนไดฟลูออไรด์
CCl4 อ่านว่า คาร์บอนเตตระคลอไรด์
3.3.3 ความยาวพันธะและพลังงานพันธะของสารโคเวเลนต์
พลังงานพันธะ หมายถึง พลังงานที่น้อยที่สุดที่ใช้เพื่อสลายพันธะ
ที่ยึดเหนี่ยวระหว่างอะตอมคู่หนึ่งๆในโมเลกุลในสถานะแก๊ส พลังงาน
พันธะสามารถบอกถึงความแข็งแรงของพันธะเคมีได้ โดยพันธะที่
แข็งแรงมากจะมีพลังงานพันธะมาก และพันธะที่แข็งแรงน้อยจะมี
พลังงานพันธะน้อย
พลังงานพันธะเฉลี่ย หมายถึง ค่าพลังงานเฉลี่ยของพลังงาน
สลายพันธะ ของอะตอมคู่หนึ่งๆ ซึ่งเฉลี่ยจากสารหลายชนิด เช่น การ
สลายโมเลกุลมีเทน (CH4 ) ให้กลายเป็นอะตอมคาร์บอนและ
ไฮโดรเจน มีสมการและค่าพลังงานที่เกี่ยวข้องดังนี้
CH4 (g) + 435 kJ → CH3 (g) + H(g)
CH 3 (g) + 453 kJ → CH 2 (g) + H(g)
CH 2 (g) + 425 kJ → CH(g) + H(g)
CH(g) + 339 kJ → C(g) + H(g)
เราจะเห็นได้ว่าการสลายพันธะระหว่าง C-H ในแต่ละพันธะของ
โมเลกุลมีเทน (CH4 ) จะใช้พลังงานไม่เท่ากัน ดังนั้น เมื่อนำค่า
พลังงานทุกค่ามาเฉลี่ย ก็จะได้เป็นค่าพลังงานพันธะเฉลี่ยนั่นเอง ดัง
แสดงในตาราง
ความยาวพันธะ หมายถึง ระยะระหว่างจุดศูนย์กลางของนิวเคลียสของอะตอมทั้งสองที่เกิดพันธะกัน ความยาวพันธะระหว่างอะตอมคู่หนึ่ง จึงหาได้จากค่าเฉลี่ย ของความยาวพันธะระหว่างอะตอมคูjเดียวกันในโมเลกุลต่างๆ เมื่อ กล่าวถึงความยาวพันธะ โดยทั่วไปจึงหมายถึง “ความยาวพันธะ เฉลี่ย ” ความสัมพันธ์ระหว่างความยาวพันธะกับพลังงานพันธะ
ความยาวพันธะและพลังงานพันธะ จะสามารถเปรียบเทียบกันได้ก็ต่อเมื่อเป็นพันธะที่เกิดจากอะตอมของธาตุคู่เดียวกัน ถ้าเป็นอะตอมต่างคู่กันเทียบกันไม่ได้ เช่น
ดังนั้น ถ้าความยาวพันธะยิ่งสั้น พลังงานพันธะก็จะยิ่งมาก หรือพันธะมีความเสถียรมาก ซึ่งจากรูปเราสามารถสรุปได้ ดังนี้
1) ความยาวพันธะ พันธะเดี่ยว > พันธะคู่ > พันธะสาม
2) พลังงานพันธะ พันธะสาม > พันธะคู่ > พันธะเดี่ยว
3) ความแข็งแรง พันธะสาม >พันธะคู่ > พันธะเดี่ยว
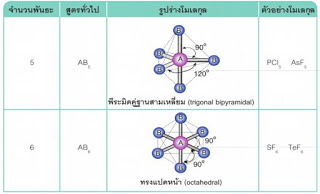
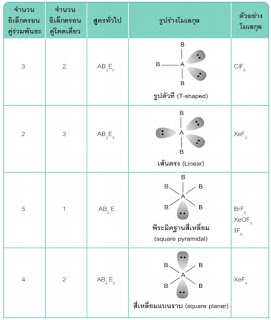
3.3.4 รูปร่างโมเลกุล 3.3.5 สภาพขั้วโมเลกุลโคเวเลนต์
ธาตุที่มีจำนวนประจุในนิวเคลียสมาก แต่มีระยะระหว่างเวเลนต์อิเล็กตรอนกับนิวเคลียสห่างกันน้อยจะมีค่าอิเล็กโทรเนกาติวิตีสูงกว่าธาตุที่มีระยะระหว่างเวเลนต์อิเล็กตรอนกับนิวเคลียสห่างกันมาก
อะตอมที่มีค่าอิเล็กโทรเนกาติวิตีสูง มีแนวโน้มที่จะแสดงอำนาจไฟฟ้าลบ
อะตอมที่มีค่าอิเล็กโทรเนกาติวิตีต่ำ มีแนวโน้มที่จะแสดงอำนาจไฟฟ้าบวก
ลักษณะสำคัญของพันธะโคเวเลนต์ไม่มีขั้ว
1) เป็นพันธะโคเวเลนต์ที่เกิดกับคู่อะตอมของธาตุชนิดเดียวกัน
2) เป็นพันธะโคเวเลนต์ที่มีการกระจายอิเล็กตรอนให้แต่ละอะตอมเท่ากัน
3) พันธะโคเวเลนต์ไม่มีขั้วอาจจะเกิดกับพันธะโคเวเลนต์ชนิดพันธะเดี่ยว เช่น Cl - Cl พันธะโคเวเลนต์ชนิดพันธะคู่ เช่น O = O และพันธะโคเวเลนต์ชนิดพันธะสาม เช่น N N
4) พันธะโคเวเลนต์ที่ไม่มีขั้วเกิดในโมเลกุลใดเรียกว่า โมเลกุลไม่มีขั้ว ( non- polar molecule)
ลักษณะสำคัญของพันธะโคเวเลนต์มีขั้ว
1) พันธะโคเวเลนต์มีขั้วเกิดกับคู่อะตอมของธาตุต่างชนิดกันที่มีค่าอิเล็กโทรเนกาติวิตีต่างกัน
2) เป็นพันธะโคเวเลนต์ที่มีการกระจายอิเล็กตรอนในแต่ละอะตอมไม่เท่ากัน
3) พันธะโคเวเลนต์มีขั้วเกิดในโมเลกุลใด โมเลกุลนั้นจะมีขั้วหรืออาจจะไม่มีขั้วก็ได้ แต่ถ้าพันธะโคเวเลนต์มีขั้ว เกิดในโมเลกุลที่มีเพียง 2 อะตอม โมเลกุลนั้นต้องเป็นโมเลกุลมีขั้วเสมอ
เขียนสัญลักษณ์แสดงขั้วของพันธะ
ใช้เครื่องหมาย อ่านว่า เดลตา โดยกำหนดให้ว่า พันธะมีขั้วใดที่อะตอมแสดงอำนาจไฟฟ้าลบ (เป็นอะตอมที่มีค่าอิเล็กโทรเนกาติวิตีสูง) ใช้เครื่องหมายแทนด้วย และพันธะโคเวเลนต์มีขั้วใดที่อะตอมแสดงอำนาจไฟฟ้าบวก (เป็นอะตอมที่มีค่าอิเล็กโทรเนกาติวิตีต่ำ ) ใช้เครื่องหมายแทนด้วย เช่น HF และ ClF
ขั่วของโมเลกุล
จากความรู้เรื่องพันธะโเวเลนต์มีขั้ว และพันธะโคเวเลนต์ไม่มีขั้วสามารถนำมาแบ่งประเภทของโมเลกุลโคเวเลนต์ได้เป็นโมเลกุลมีขั้ว และโมเลกุลไม่มีขั้ว แต่โมเลกุลโคเวเลนต์ใดจะเป็นโมเลกุลมีขั้ว หรือ ไม่มีขั้วนั้นสามารถพิจารณาได้ดังนี้
ก. โมเลกุลที่มีเพียง 2 อะตอม
ถ้าโมเลกุลโคเวเลนต์ใดมีเพียง 2 อะตอม และเป็นอะตอมของธาตุชนิดเดียวกัน พันธะที่เกิดขึ้นในโมเลกุลเป็นพันธะโคเวเลนต์ไม่มีขั้ว ดังนั้น โมเลกุลก็จะเป็นโมเลกุลไม่มีขั้วด้วย เช่น H2 , O2 , N2
ถ้าโมเลกุลโคเวเลนต์ใดมีเพียง 2 อะตอม และเป็นอะตอมของธาตุต่างชนิดกัน พันธะที่เกิดขึ้นในโมเลกุลเป็นพันธะโคเวเลนต์มีขั้ว ดังนั้นโมเลกุลก็จะเป็นโมเลกุลมีขั้วด้วย เช่น HCl , ClF , HI
ข. โมเลกุลที่มี 3 อะตอมหรือมากกว่า
ถ้าโมเลกุลที่เกิดจากพันธะมีขั้ว และมีรูปร่างของโมเลกุลสมมาตร โมเลกุลนั้นจะเป็นโมเลกุลไม่มีขั้ว เพราะมีผลรวมของทิศทางของแรงดึงดูดอิเล็กตรอนทั้งหมดในโมเลกุลเป็นศูนย์ เช่น
VIDEO
VIDEO
VIDEO
3.3.6 แรงยึดเหนี่ยวระหว่างโมเลกุลและสมบัติของสารโคเวเลนต์
การเปลี่ยนสถานะของสารต้องมีการให้ความร้อนแก่สาร เพื่อให้อนุภาคของสารมีพลังงานจลน์สูงพอที่จะหลุดออกจากกัน แสดงว่าสารแต่ละสถานะมีแรงยึดเหนี่ยวระหว่างโมเลกุล ซึ่งเรียงลำดับจากมากไปน้อยดังนี้ ของแข็ง > ของเหลว > ก๊าซ
การเปลี่ยนสถานะของสารโคเวเลนต์ มีการทำลายแรงยึดเหนี่ยวระหว่างโมเลกุลเท่านั้น ไม่มีการทำลายพันธะเคมี ดังนั้นสารที่มีจุดเดือดจุดหลอมเหลวสูง แสดงว่าแรงยึดเหนี่ยวระหว่างโมเลกุลสูง
ประเภทของแรงยึดเหนี่ยวระหว่างโมเลกุลโคเวเลนต์ มีดังนี้
แรงลอนดอน ( london foece ) เป็นแรงยึดเหนี่ยวระหว่างโมเลกุล ยึดเหนี่ยวกันด้วยแรงอ่อนๆ ซึ่งเกิดขึ้นในสารทั่วไป และจะมีค่าเพิ่มขึ้นตามมวลโมเลกุลของสาร
แรงดึงดูดระหว่างขั้ว ( dipole – dipole force ) เป็นแรงดึงดูดทางไฟฟ้าอันเนื่องมาจากแรงกระทำระหว่างขั้วบวกกับขั้วลบของโมเลกุลที่มีขั้ว *สารโคเวเลนต์ที่มีขั้ว มีแรงยึดเหนี่ยวระหว่างโมเลกุล 2ชนิดรวมอยู่ด้วยกันคือ แรงลอนดอนกับแรงดึงดูดระหว่างขั้ว และเรียกแรง 2แรงรวมกันว่า แรงแวนเดอร์วาลส์ *
พันธะไฮโดรเจน ( hydrogen bond , H – bond ) คือ แรงดึงดูดระหว่างโมเลกุลที่เกิดจากไฮโดรเจนอะตอมสร้างพันธะโคเวเลนต์ กับอะตอมที่มีค่าอิเล็กโทรเนกาติวิตีสูงๆและมีขนาดเล็ก ได้แก่ F , O และ N แล้วเกิดพันธะโคเวเลนต์มีขั้วชนิดมีสภาพขั้วแรงมาก ทั้งนี้เนื่องจากพันธะที่เกิดขึ้นนี้อิเล็กตรอนคู่รวมพันธะจะถูกดึงเข้ามาใกล้อะตอมของธาตุที่มีค่าอิเล็กโทรเนกาติวิตีสูง มากกว่าทางด้านอะตอมของไฮโดรเจนมาก และอะตอมของธาตุที่มีค่าอิเล็กโทรเนกาติวิตีสูง ยังมีอิเล็กตรอนคู่โดดเดี่ยว จึงเกิดดึงดูดกันระหว่างอิเล็กตรอนคู่โดดเดี่ยวกับอะตอมของไฮโดรเจนชึ่งมีอำนาจไฟฟ้าบวกสูงของอีกโมเลกุลหนึ่ง ทำให้เกิดเป็น พันธะไฮโดรเจน
VIDEO
สมบัติของสารประกอบโคเวเลนต์
1) มีจุดเดือดจุดและหลอมเหลวต่ำ เพราะจะทำให้เดือดหรือหลอมเหลวต้องใช้พฃังงานไปในการทำลายแรงยึดเหนี่ยวระหว่างโมเลกุล ( ไม่ได้ ทำลายพันธะโคเวเลนต์ ยกเว้นโครงผลึกร่างตาข่าย ) อาจจะแบ่งสารโคเวนต์ตามจุดเดือด จุดหลอมเหลว จะได้ 4 พวกดังนี้
1.1 สารโคเวเลนต์ไม่มีขั้ว พวกนี้จะมีจุดเดือดจุดหลอมเหลวต่ำกว่าพวกอื่นๆ เพราะโมเลกุลยึดเหนี่ยวกันด้วยแรงลอนดอนอย่างเดียวเท่านั้น
1.2 สารโคเวเลนต์มีขั้ว พวกนี้จะมีจุดเดือดจุดหลอมเหลวสูงกว่าพวกไม่มีขั้ว เพราะยึดเหนี่ยวโมเลกุลด้วยแรง 2 แรง คือแรงลอนดอลและ แรงดึงดูดระหว่างขั้ว
1.3 สารโคเวเลนต์ที่สามารถสร้างพันธะไฮโดรเจนได้ เช่น HF , NH3 , H2O พวกนี้จะมีจุดเดือดจุดหลอมเหลวสูงกว่าสารโคเวเลนต์ที่มีขั้ว เพราะโมเลกุลยึดเหนี่ยวกันด้วยแรงแวนเดอร์วาลส์และพันธะไฮโดรเจน
1.4 พวกที่มีโครงสร้างเป็นโครงผลึกร่างตาข่าย เช่น เพชร แกรไฟต์ คาร์บอรันดัม ซิลิกอนไดออกไซด์ พวกนี้มีจุดเดือดจุดหลอมเหลวสูงมาก ซึ่งโดยทั่วไปสารโคเวเลนต์มีจุดเดือดจุดหลอมเหลวต่ำ ที่เป็นเช่นนี้เพราะการจัดเรียงอะตอมภายในผลึก
2) สารโคเวเลนต์จะไม่นำไฟฟ้าไม่ว่าจะอยู่ในสถานะใด ( ยกเว้น แกรไฟต์ ) เนื่องจากไม่มีอิเล็กตรอนอิสระ และเมื่อหลอมเหลวไม่แตกตัว เป็นไอออน
3)โมเลกุลที่มีขั้วสามารถละลายในตัวทำละลายที่โมเลกุลมีขั้วได้ และโมเลกุลที่ไม่มีขั้วสามารถละลายในตัวทำละลายที่ไม่มีขั้วได้ (มีขั้วกับมีขั้ว , ไม่มีขั้วกับไม่มีขั้ว= ละลายกันได้ แต่มีขั้วกับไม่มีขั้วไม่ละลายกัน )
3.3.7 สารโคเวเลนต์ร่างตาข่าย
สารโคเวเลนต์ที่ศึกษามาแล้วมีโครงสร้างโมเลกุลขนาดเล็ก มีจุดหลอมเหลวและจุดเดือดต่ำ แต่มีสารโคเวเลนต์บางชนิดมีจุดเดือดจุดหลอมเหลวจะสูงมาก โครงสร้างโมเลกุลขนาดใหญ่เพราะเกาะกันแบบโครงร่างตาข่าย เรียกว่า สารโครงผลึกร่างตาข่าย เช่น เพชร แกรไฟต์ SiC, SiO2
12.1 เพชร (Diamond)
เพชร เป็นอัญรูปหนึ่งของคาร์บอนและเป็นผลึกร่างตาข่าย โครงสร้างของเพชร ประกอบด้วยอะตอมของคาร์บอน ซึ่งคาร์บอนแต่ละอะตอมใช้เวเลนซ์อิเล็กตรอนทั้งหมดสร้างพันธะแบบโคเวเลนต์กับอะตอมคาร์บอน ไม่นำไฟฟ้า เพราะว่าคาร์บอนสร้างพันธะไปทุกทิศทุกทาง ทำให้เพชรมีความแข็งมากกว่าอัญรูปอื่น ๆ ของคาร์บอน
12.2 แกรไฟต์ (Graphite)
แกรไฟต์ เป็นผลึกโคเวเลนต์และเป็นอีกรูปหนึ่งของคาร์บอนแต่มีโครงสร้างต่างจากเพชรคือ อะตอมคาร์บอนจะสร้างพันธะ โคเวเลนต์ต่อกันเป็นวง วงละ 6 อะตอมต่อเนื่องกันอยู่ภายในระนาบเดียวกัน ซึ่งการจัดเรียงตัวแบบโครงผลึกร่างตาข่ายนี้ทำให้แกรไฟต์มีจุดเดือดจุดหลอมเหลวสูง และสามารถนำไฟฟ้าได้ เนื่องจากคาร์บอนในโครงผลึกของ แกรไฟต์มี 4 เวเลนซ์อิเล็กตรอน แต่ละอะตอมสร้างพันธะกับคาร์บอนข้างเคียง 3 อะตอม จึงเหลืออีก 1อิเล็กตรอนอิสระที่สามารถเคลื่อนที่ได้ภายในชั้น และแต่ละชั้นไม่ได้สร้างพันธะกัน จึงทำให้ระหว่างชั้นไม่มีความแข็งแรงมาก สามารถเลื่อนไถลได้ง่าย ทำให้มีสมบัติในการหล่อลื่น เราจึงนำไปทำไส้ดินสอ สารหล่อลื่น เป็นต้น
12.3 ซิลิคอนไดออกไซด์ (SO2 ) หรือซิลิกา
ซิลิคอนไดออกไซด์เป็นผลึกโคเวเลนต์ที่มีโครงสร้างเป็นผลึกร่างตาข่าย อะตอมของซิลิคอนจัดเรียงตัวเหมือนคาร์บอนในผลึกเพชร แต่มีออกซิเจนคั่นอยู่ระหว่างอะตอมของซิลิคอนแต่ละคู่ ผลึกซิลิคอนไดออกไซด์จึงมีจุดหลอมเหลวสูง และมีความแข็งสูง ใช้เป็นวัสดุในการทำแก้ว ทำส่วนประกอบของนาฬิกาควอร์ตซ์ ใยแก้วนำแสง
สารประกอบอื่นๆ ของซิลิคอนที่มีโครงสร้างเป็นโครงผลึกร่างตาข่าย ได้แก่ ซิลิคอนคาร์ไบด์ ( SiC ) หรือ คาร์โบรันดัม มีจุดหลอมเหลวสูง มีความแข็งมาก ใช้ทำเครื่องบด เครื่องโม่ หินลับมีด
3.4 พันธะโลหะ
โลหะ สามารถนำไฟฟ้าและความร้อนได้ดี มีลักษณะเป็นเงาและมีความวาวเมื่อถูกแสง นอกจากนี้ยังสามารถดึงเป็นเส้น ตีเป็นแผ่น หรือบิดงอได้โดยไม่แตกหัก ซึ่งคุณสมบัติที่สำคัญเหล่านี้ก็เนื่องจากโลหะยึดกันด้วยพันธะชนิดหนึ่ง นั่นก็คือ พันธะโลหะ
ทฤษฎีที่ใช้อธิบายพันธะโลหะ
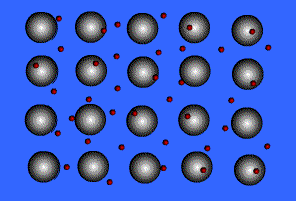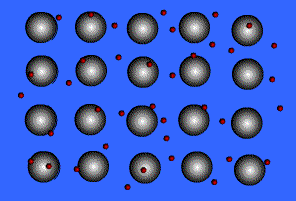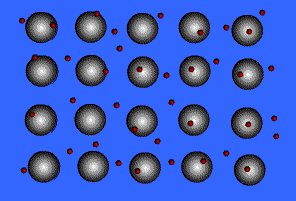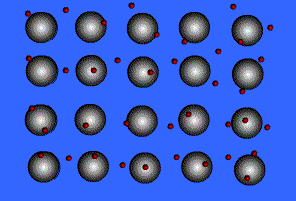
1) แบบจำลองทะเลอิเล็กตรอน ( electron sea model )
2) ทฤษฎีแถบพลังงาน ( band theory )
1) แบบจำลองทะเลอิเล็กตรอน ( electron sea model )
จากรูปแสดงลักษณะของพันธะโลหะ ทรงกลมสีเทาคือ ไอออนบวกของโลหะ ทรงกลมสีแดงที่เคลื่อนที่อยู่ตลอดเวลานี้ คือ อิเล็กตรอน เรามักเรียกแบบจำลองของการเกิดพันธะโลหะนี้ว่า ทะเลอิเล็กตรอนเนื่องจากในผลึกของโลหะมีจำนวนอิเล็กตรอนมหาศาลที่ไหลไปมาได้อย่างอิสระตลอดเวลา โลหะมีค่าพลังงานไออไนเซซันที่ต่ำ ดังนั้นจึงยึดอิเล็กตรอนวงนอกสุดไว้อย่างหลวมๆ ทำให้อิเล็กตรอนเหล่านี้เคลื่อนที่ไปมารอบๆโลหะตลอดเวลาเหมือนกับว่าไม่ได้เป็นอิเล็กตรอนของอะตอมตัวใดตัวหนึ่ง แต่เป็นเสมือนกับว่าเป็นของอะตอมทุกตัว (มีล้านๆอะตอมในผลึกโลหะ) ซึ่งอิเล็กตรอนเหล่านี้ทำหน้าที่คล้ายซีเมนต์ ที่ช่วยยึดไอออนของโลหะที่มีประจุบวกให้อยู่ในตำแหน่งที่คงที่
2. ทฤษฎีแถบพลังงาน (band theory) เมื่อออร์บิทัลอะตอมสองออร์บิทัลมารวมกันจะได้ออร์บิทัลโมเลกุลสองชนิดคือ ออร์บิทัลโมเลกุลแบบมีพันธะ (bonding molecular orbital) และออร์บิทัลโมเลกุลแบบต้านพันธะ (anti-bonding molecular orbital) ดังเช่นกรณีของ Li2 (Li : 1s2 2s1 ) ซึ่งแสดงออร์บิทัลโมเลกุลที่ระดับ 2s ได้ดังนี้
เมื่อมีอะตอมมากขึ้นและจำนวนออร์บิทัลโมเลกุลมากขึ้น ระดับพลังงานจะใกล้ชิดกันมากขึ้นจนดูเหมือนว่าเป็นแถบต่อเนื่องกัน แถบดังกล่าวนี้ เรียกว่า แถบพลังงาน (energy band) ดังรูป แถบอนุญาต (allowed band) สำหรับช่วงที่ว่างที่ไม่มีแถบพลังงานเรียกว่า ช่องต้องห้าม (forbidde) 3.4.2 สมบัติของโลหะ ตัวนำไฟฟ้า กึ่งตัวนำ และฉนวน
เมื่อพิจารณากรณีของ สารตัวนำไฟฟ้า จะเห็นว่าแถบเวเลนซ์มีลักษณะเป็นแถบที่เต็มบางส่วนซึ่งก็คือ ในออร์บิทัลมีทั้งส่วนที่ว่างและส่วนที่มีอิเล็กตรอนบรรจุอยู่ ซึ่งลักษณะเช่นนี้ เมื่ออิเล็กตรอนได้รับพลังงานจากสนามไฟฟ้า ก็จะสามารถเคลื่อนที่ไปอยู่ในส่วนที่ว่างของออร์บิทัลได้ทำให้โลหะนำไฟฟ้าได้ อย่างไรก็ตาม นอกจากโลหะจะมีแถบเวเลนซ์ที่มีลักษณะเป็นแถบที่เต็มบางส่วนแล้ว ยังสามารถมีแถบที่เต็มแล้วแต่สามารถเกิดการซ้อนเหลื่อม กับแถบนำไฟฟ้า(แถบที่ว่าง) ที่มีระดับพลังงานสูงกว่าแต่ใกล้เคียงกันได้จึงทำให้โลหะนำไฟฟ้าได้ หรือแม้แต่แถบที่เต็มบางส่วน ก็สามารถซ้อนเหลื่อมกับแถบนำไฟฟ้าที่มีระดับพลังงานสูงกว่าแต่ใกล้เคียงกันได้ เมื่ออิเล็กตรอนได้รับพลังงานจากสนามไฟฟ้า อิเล็กตรอนในแถบเวเลนซ์ (แถบที่เต็มแล้ว) ไม่สามารถเคลื่อนที่ไปอยู่ในแถบนำไฟฟ้าได้เนื่องจากช่องต้องห้ามค่อนข้างกว้าง แต่อย่างไรก็ตาม ถ้าทำการกระตุ้นอิเล็กตรอนโดยให้พลังงานที่สูงกว่าช่วงของช่องต้องห้าม เช่น ให้ความร้อน หรือฉายแสง อิเล็กตรอนก็จะสามารถเข้ามาอยู่ในแถบนำไฟฟ้าได้ ดังนั้นจึงสามารถนำไฟฟ้าได้ โดยทั่วไปแล้วช่องต้องห้ามระหว่างแถบเวเลนซ์ และแถบนำไฟฟ้าของสารกึ่งตัวนำมักจะไม่กว้างนัก และโลหะกึ่งตัวนำมักจะเป็นตัวนำที่ดีเมื่ออุณหภูมิสูงขึ้น
เรโซแนนซ์ (resonance)
หมายถึงการสลับตำแหน่งของพันธะต่างชนิดที่เกิดขึ้นในโมเลกุลเดียวกัน โดยอะตอมของทุกธาตุในโมเลกุลอยู่ในตำแหน่งเดิม ทำให้เขียนสูตรโครงสร้างของสารชนิดเดียวกันได้หลายแบบ เช่น SO2 SO3 HCO2 - NO2 - , NO3 - CO3 2- C6 H6 (benzene) O3 แต่ละชนิดจะมีโครงสร้างโมเลกุลจากการเกิดเรโซแนนซ์ (resonance structures) ได้หลายแบบ ดังนี้
SO2 เกิดเรโซแนนซ์ได้ 2 แบบ( 2 resonance structures) ดังนี้
SO 3 เกิดเรโซแนนซ์ได้ 3 แบบ( 3 resonance structures) ดังนี้
HCO 2 - เกิดเรโซแนนซ์ได้ 2 แบบ ( 2 resonance structures) ดังนี้
NO 2 - เกิดเรโซแนนซ์ได้ 2 แบบ ( 2 resonance structures) ดังนี้
NO 3 - เกิดเรโซแนนซ์ได้ 3 แบบ ( 3 resonance structures) ดังนี้
VIDEO
3.5 การใช้ประโยชน์ของสารประกอบไอออนิก สารโคเวเลนต์ และโลหะ
จากการที่สารประกอบไอออนิกสารโคเวเลนต์และโลหะมีสมบัติเฉพาะตัวมาว่าการที่ต่างกันจึงสามารถนำมาใช้ประโยชน์ในด้านต่างๆได้ตามความเหมาะสม เช่น
- แอมโมเนียมคลอไรด์และซิงค์คลอไรด์ เป็นสารประกอบไอออนิกที่สามารถนำไฟฟ้าได้จากการแตกตัวเป็นไอออนเมื่อละลายน้ำจึงนำไปใช้เป็นสารอิเล็กโทรไลต์ในถ่านไฟฉาย
- พอลิไวนิลคลอไรด์หรือ PVC เป็นสารโคเวเลนต์ที่ไม่สามารถนำไฟฟ้าได้จึงเป็นฉนวนไฟฟ้าที่หุ้มสายไฟฟ้า
- ซิลิกอนคาร์ไบด์ เป็นสารโคเวเลนต์โครงร่างตาข่ายที่มีจุดหลอมเหลวสูงและมีความแข็งแรงมากจึงนำไปใช้ทำเครื่องบด
- ทองแดงและอะลูมิเนียม เป็นโลหะที่นําไฟฟ้าได้ดีจึงนำไปใช้เป็นตัวนำไฟฟ้าอลูมิเนียมและเหล็กเป็นโลหะที่นําความร้อนได้ดีจึงนำไปทำภาชนะสำหรับประกอบอาหาร เช่น หม้อ กะทะ







 Cl
Cl






















ไม่มีความคิดเห็น:
แสดงความคิดเห็น